Berliner Blau – Überblick und Herstellung
Bei Berliner Blau handelt es sich um ein dunkelblaues, geruchloses, anorganisches Pigment, welches erstmals 1706 hergestellt wurde und den frühesten Vertreter von nicht in der Natur vorkommenden Pigmenten darstellt.
Was ist ein Pigment?
Pigmente (von lat. pigmentum für ,,Farbe”) sind Farbmittel, also färbende Stoffe, die im Unterschied zu Farbstoffen im Anwendungsmedium unlöslich sind (sie liegen als sehr kleine Kristalle vor). Pigmente entstehen als Primärteilchen, welche sich über ihre Flächen zu sogenannten Aggregaten verbinden. Die Aggregate können unter sich oder mit Primärteilchen durch Verbindung über die Ecken / Kanten Agglomerate bilden. Durch die Reflexion und Emission von Licht durch diese Strukturen entsteht der farbliche Eindruck. Somit haben die Eigenschaften beim Bilden von Aggregaten und Agglomeraten auch einen Einfluss auf die Farbe. In vielen Fällen bestehen Pigmente aus Komplexen mit aus der Struktur folgenden farbgebenden Eigenschaften.
Chemische Struktur von Berliner Blau
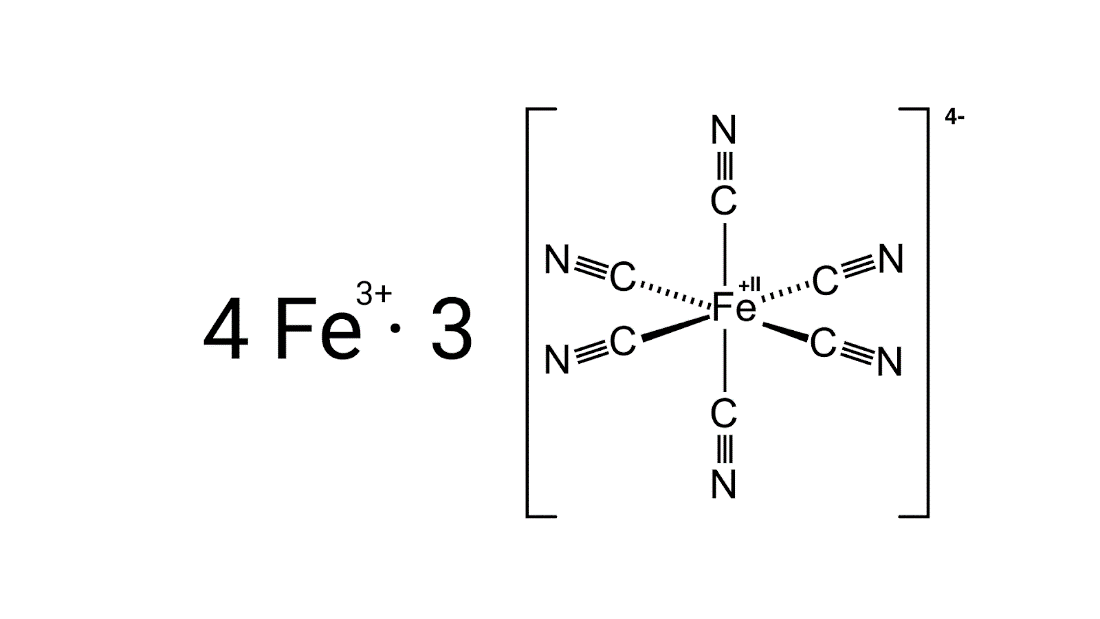
Berliner Blau ist ein Komplexsalz, bestehend aus einem vierfach negativ geladenen Komplex-Ion und hiermit salzbildenen Kationen. Genauer handelt es sich um ein Metall-Komplexsalz, wobei in das Salzgitter in der als Pigment verwendeten unlöslichen Form Wasser gebunden ist. Somit ergibt sich: Fe4[Fe(Cn)6]3 * 14-16 H2O
Was sind Komplexe?
Komplexe bestehen aus Zentralteilchen (häufig Metall-Kationen) und Liganden (häufig Anionen), welche in spezifischen geometrischen Formen an das Zentralteilchen gebunden sind. Ist die Komplexeinheit geladen, wird von einem Komplex-Ion gesprochen, welches sich mit Kationen zu einem Komplexsalz verbinden kann.
Was macht Metall-Komplexverbindungen aus?
Bei Metall-Komplexverbindungen bilden sich zwischen den Liganden und den Zentralteilchen koordinative Bindungen aus, welche dadurch gekennzeichnet sind, dass beide Bindungselektronen durch den Liganden zur Verfügung gestellt werden.
Die Grundstruktur des Berliner Blaus
Beim Berliner Blau bilden drei vierfach negativ geladene Hexacyanidoferrat(II)-Ionen (Komplex-Ionen) in Verbindung mit vier dreifach positiv geladenen Eisenkationen das Komplexsalz Eisen(III)-hexacyanidoferrat(II/III). Bei solchen Verbindungen zu Komplexsalzen stellt das Komplex-Ion die eigentliche Komplexeinheit dar und wird bei der Darstellung in Klammern gesetzt (in der Grafik rechts). Im Fall des Berliner Blaus steht somit das vierfach negativ geladene Hexacyanidoferrat-Ion in Klammern, welches durch koordinative Bindungen von 6 Nitrilgruppen an ein zweifach positiv geladenes Eisenkation entsteht. Durch die negative Ladung der Nitrilgruppen ist die gesamte Ladung vierfach negativ, sodass es zum Ladungsausgleich zu der oben genannten Komplexsalz-Verbindung aus drei Komplex-Ionen und vier Kationen kommt.
Herstellung von Berliner Blau
Materialien
|
Laborbedarf |
Chemikalien |
|
3x Becherglas (100 ml) |
100 ml Wasser 20g Eisen(III)-chlorid 14g Kaliumhexacyanidoferrat(II) (K4[Fe(CN)6]) |
Durchführung
Zuerst muss eine (möglichst) gesättigte Eisen(III)chlorid-Lösung hergestellt werden. Dazu löst man ca. 20g Eisen(III)chlorid in 50mL destilliertem Wasser. Um sich später mehrfache ‘Waschgänge’ des Endprodukts zu ersparen, ist es sinnvoll, die Lösung zu filtrieren, da sonst Rückstände des festen Eisen(III)chlorids im Berliner Blau zurückbleiben, die mit Wasser ausgewaschen werden müssen. Filtriert man die Eisen(III)chlorid-Lösung, reduziert man den Aufwand hierbei deutlich. Wir verzichteten allerdings auf diesen Schritt und mussten das Berliner Blau während Filtration mehrfach mit Wasser spülen, bis das Permeat eine bläulich-grüne Farbe angenommen hatte.
Als nächstes muss eine Kaliumhexacyanoferrat(II)-Lösung angesetzt werden. Hierzu gibt man ca. 14g Kaliumhexycyanidoferrat zusammen mit etwa 50ml destilliertem Wasser und einem Rührfisch in ein Becherglas und stellt dieses auf eine Heizplatte mit Rührfunktion. Die Heizfunktion der Heizplatte wird nicht verwendet. Dies ist von Vorteil, da einiges Rühren vonnöten ist, um eine klare Lösung herzustellen. Sind nach einiger Zeit bei konstantem Rühren immer noch feste Bestandteile zu sehen, muss nach und nach mehr Wasser hinzu gegeben werden, bis die Lösung klar ist.
Nun folgt die tatsächliche Herstellung des Berliner Blaus. Hierzu werden einfach beide Lösungen in einem Becherglas zusammengegeben. Wenn man tröpfchenweise Eisen(III)chlorid-Lösung in die Kaliumhexacyanidoferrat(II)-Lösung gibt, kann sehr schön die sofortige Bildung des Pigments bei Zusammenkommen beider Lösungen beobachtet werden. Gibt man die komplette Eisen(III)chlorid-Lösung in die Kaliumhexacyanidoferrat(II)-Lösung und rührt diese etwas um, erhält man eine sehr dickflüssige, tiefblaue bis schwarze Suspension des Pigments in Wasser. Das außerdem entstehende Kaliumchlorid wird im Wasser gelöst. Wenn von einem der Edukte zu viel verwandt wurde, verbleibt dies auch in der Lösung. Wenn zu viel Eisen(III)chlorid oder Kaliumhexycyanidoferrat(II) in einer der Lösungen war, diese also übersättigt war, verbleibt dies als Feststoff in der Suspension und muss später ausgewaschen werden.
Als nächstes wird die Suspension filtriert, wodurch das meiste Wasser aus dem Pigment entzogen wird. Dies kann durch Vakuumfiltration stark beschleunigt werden, wir verzichteten allerdings auf diesen Schritt und ließen den Aufbau zwischen zwei Chemiestunden stehen. Ist das Filtrat gelblich, bedeutet dies, dass im Filterkuchen noch Eisen(III)chlorid vorhanden ist. Dies muss um ein reines Pigment herzustellen mit Wasser ausgewaschen werden. Hierzu gibt man der Suspension immer wieder Wasser hinzu, bis das Filtrat eine blaue bis grüne Farbe angenommen hat.
Zuletzt gibt man den Filterkuchen, der nun nur noch Berliner Blau enthalten sollte, in eine Kristallisierschale und lässt ihn trocknen. Dies kann durch einen Trockenschrank stark beschleunigt werden. Außerdem kann so sichergestellt werden, dass dem Pigment sämtliches verbliebenes Wasser entzogen wird.
Um das Berliner Blau als Pigment verwenden zu können, muss es nun noch zerkleinert werden. Dies kann unter Verwendung eines Mörsers geschehen, allerdings ist die Körnung, die hiermit erzielt werden kann, meist noch zu groß. Daher kann zum Beispiel eine Kaffeemühle verwendet werden, um ein sehr feines Pulver herzustellen.
Beobachtung
Beim Mischen kommt es zu dem Ausfall eines dunkelblauen Feststoffs.
Sind beide Lösungen komplett zusammengegeben, erhält man eine sehr dickflüssige Suspension dunkelblauer Farbe.
Bei der Filtrierung der Suspension zeigt der Filter eine starke Verfärbung. Die Braune Farbe im oberen Bereich rührt vom gelösten Eisen(III)chlorid her, welches im vollgesogenen Filter zurückbleibt, wenn das Wasser verdunstet ist.
Deutung
Es entsteht Berliner Blau, wobei durch das Vorhandensein von Fe3+ und Fe2+ Ionen ein farbgebender Charge-Transfer-Übergang zustande kommt.
Verwendung
Berliner Blau wird aufgrund seiner Feinkörnigkeit und seiner großen Farbstärke vor allem für verschiedenste Farben verwendet. Für Wandfarben ist es allerdings nicht verwendbar, da es schnell verbraunt.
In der Metallverarbeitung wird Berliner Blau als Paste verwendet, um die Qualität von Oberflächen beurteilen zu können.
Heute wird Berliner Blau in den größten Mengen für chemische Beschichtungen, für Druckfarben, sowie für Kohlepapier verwendet.
Medizinisch wird Berliner Blau zur Bindung verschiedener Gifte eingesetzt. Unter anderem wurde es als Radiogardase-Cs nach der Katastrophe von Tschernobyl eingesetzt, um Tiere zu dekontaminieren, die radioaktives 137Cs aufgenommen hatten. Auch bei anderen Nuklearkatastrophen wie dem Goiânia-Unfall kam Berliner Blau zur Dekontamination von Menschen und Gegenständen zum Einsatz.
Empfehlungen
Sie möchten mir einen Kaffee spendieren?
Anmerkungen oder sonstige Ideen und Vorschläge können Sie gern per Mail an info@lernzettel.org bzw. fehler@lernzettel.org senden.