Chemie → Aminosäuren und Proteine →
Nachweis und Trennung von Aminosäuren
Dünnschichtchromatographie
Über die Dünnschichtchromatographie ist es möglich, Proben zu trennen und auf diese Weise die Zusammensetzung zu ermitteln. Bei dem 1938 von den russischen Forschern N. A. Izmailov und M. S. Shraiber entwickelten Verfahren kommt eine Trennung durch physikalische und chemische Effekte zustande.
Materialien für die Durchführung
Chemikalien
- Aminosäurelösungen (5 mg der jeweiligen Aminosäure in 10 ml Wasser)
- Alaninlösung
- Glycinlösung
- Valinlösung
- Probe aus gleichen Mengen aller Aminosäurelösungen
- Laufmittel (mobile Phase) aus Butan-1-ol, Eisessig und Wasser im Verhältnis 4:1:1
- Ninhydrinreagenz aus 0,2 g Ninhydrin in 100 ml Propan-2-ol
Weitere Materialien
- Dünnschichtchromatographieplatte mit einer Trennschicht aus Kieselgel (stationäre Phase)
- 4 Bechergläser (50 ml)
- 4 Kapillaren
- Chromatographiekammer
- Sprühflasche
- Trockenschrank
Durchführung
Zuerst wird abhängig von der Größe der Chromatographiekammer das Laufmittel aus Butan-1-ol, Eisessig und Wasser im Verhältnis 4:1:1 erstellt, sodass es die Kammer später zu 0,5 cm füllt. Nachdem das Laufmittel in die Kammer gegeben wurde, wird der Deckel geschlossen, um eine Sättigung der Luft im Behälter zu erreichen. In drei der Bechergläser wird jeweils eine Aminosäurelösung gegeben, in das vierte Becherglas kommt eine Mischung aus gleich großen Anteilen der Lösungen. Die Bechergläser sollten in einer bestimmten Reihenfolge stehen, welche notiert wird und beim Auftragen auf das Kieselgel nicht mehr verändert werden sollte. Das Auftragen auf die Trennschicht (Kieselgel) gelingt über Kapillare. Die aufgetragene Menge sollte 5–20 Mikrogramm betragen, wobei die Proben nebeneinander in einer Höhe von einem Zentimeter auf der Trennschicht platziert werden. Die Chromatographieplatte wird im Anschluss Aufrecht in die Chromatographiekammer gestellt, welche anschließend wieder verschlossen wird (die Proben dürfen das Laufmittel nicht berühren, was aber beim Aufrechten Platzieren aufgrund des Höhenunterschieds von 0,5 cm zwischen Probe und Laufmittel nicht passieren kann).
Sobald das Laufmittel eine Höhe zwei Zentimeter unter dem Ende der Chromatographieplatte erreicht hat, wird die Platte aus der Kammer entfernt, um nun das Laufmittel durch einen Föhn verdampfen / vertrocknen zu lassen. Danach wird die Platte unter dem Abzug mit der Ninhydrinlösung besprüht (hierfür wird die Sprühflasche genutzt) und anschließend im Trockenschrank getrocknet.
Beobachtung
Es lässt sich beobachten, dass sich das Gemisch trennt und die Stoffe einen unterschiedlichen Weg auf der Platte zurücklegen. Es lassen sich diese Stoffe mit den einzelnen Stoffen vergleichen, sodass ein Bezugswert entsteht und somit auf die Identität rückgeschlossen werden kann. Wie in der Deutung näher erläutert, lässt Glycerin am Wenigsten Bewegung erkennen, gefolgt von Alanin und Valin mit der größten Bewegung.
Deutung
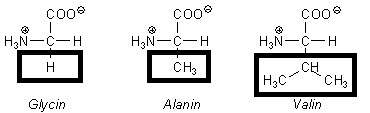
Zuerst kam es durch das Schließen der Chromatographiekammer zur Sättigung der Luft der Kammer, sodass unerwünschte Nebeneffekte durch das Verdunsten während des Versuches verhindert wurden. Nach Anfertigen und Auftragen der Lösungen auf die stationäre Phase (Kieselgel), wurde diese in die Chromatographiekammer gestellt, wobei die Proben das Laufmittel nicht berühren durften, um sich nicht in diesem zu Lösen. Nach dem Hineinstellen wird der Deckel wieder auf die Kammer gelegt, um wie oben beschrieben Nebeneffekte zu vermeiden. Sobald die Chromatographieplatte im Laufmittel steht, wird dieses durch die Kapillarkräfte an der Trennschicht nach oben gezogen. Die Proben, welche sich auf der dem Kieselgel (stationäre Phase) befinden, bewegen sich durch die Wechselwirkungen mit der stationären und mobilen Phase und die jeweiligen Absorptionen unterschiedlich schnell. Die Teilchen wechseln die Phasen abhängig von den auf sie wirkenden Kräften. Je länger sich ein Teilchen in der mobilen Phase (dem Laufmittel) befindet, desto weiter kommt es mit einer höheren Geschwindigkeit nach oben. Für eine hohe Geschwindigkeit muss die Wechselwirkung mit der stationären Phase (Kieselgel) minimal und die mit der mobilen Phase (Laufmittel) maximal sein. Die Wechselwirkungen erlauben es, Stoffe aufgrund ihrer unterschiedlichen Beschaffenheit zu trennen und zu identifizieren. Für die Wechselwirkungen spielen hauptsächlich die unterschiedlichen Polaritäten der Phasen und getesteten Aminosäuren eine Rolle. In unserem Experiment handelt es sich um ein polares Kieselgel und ein unpolares Laufmittel. Es sollte ,,je polarer, desto langsamer” für die Aminosäuren gelten. Alle Aminosäuren teilen bis auf ihren Rest die gleiche Struktur. Somit ist für den Unterschied in der Bewegung nur die Polarität und Größe des Restes wichtig.
Das Glycin besitzt als Rest ein einzelnes Wasserstoffatom, welches zwar unpolar ist, allerdings auch nur einen sehr geringen Teil des Moleküls ausmacht. Das Glycin ist aufgrund des kleinsten unpolaren Restes das polarste Molekül dieser Reihe und somit durch die stärkeren polaren Wechselwirkungen zum Kieselgel und die schwächeren Wechselwirkungen mit dem Laufmittel am langsamsten. Der Rest des Alanins ist unpolar, allerdings auch klein, es ist schneller als das Glycin. Das Valin ist mit dem größten unpolaren Rest am schnellsten. Durch die unterschiedlichen Geschwindigkeiten lassen sich Stoffe an Hand vorheriger Messungen bestimmen. Die Geschwindigkeiten sorgen auch für die Trennung von gemischten Aminosäuren in die einzelnen Bestandteile. Die Bestandteile lassen sich durch ihren Rf-Wert identifizieren. Dieser ist der Quotient aus der Strecke, welche die Probe von der Startlinie aus zurückgelegt hat und der Strecke, welche das Laufmittel von der Startlinie aus insgesamt zurückgelegt hat. Durch die zurückgelegte Strecke einer Standardsubstanz können die Ergebnisse vergleichbar gemacht werden. Die Größe der Fläche, auf der sich die Probe am Ende befindet, lässt zudem über die Absorption Rückschlüsse auf den Stoff zu. Bei allen Proben wirkt die Diffusion der Trennung entgegen, dieser Einfluss kann durch die Beschaffenheit der Trennschicht vermindert werden, indem die Zeit in den verschiedenen Phasen verringert werden. Um das Ergebnis zu sehen werden die Aminosäuren durch die Ninhydrin-Lösung sichtbar gemacht. Bei primären Aminosäuren wird die Aminosäure decarboxyliert (CO2 wird abgespalten) und die Aminogruppe auf das Ninhydrin übertragen. Die Aminosäure wird zum Aldehyd. Mit einem weiteren Ninhydrin Molekül bildet sich ein violettes Produkt (Ruhemanns Purpur).
Vorteile
- Geringer Zeitaufwand
- Geringe Mengen von Nöten
- Preiswert
- Vielseitig
Nachteile
- Eine Quantitative Analyse der Stoffe ist durch den Versuchsaufbau extrem schwierig
Elektrophorese
Materialien für die Durchführung
- Wasser
- Papier
- Stromkreis (Draht, Stromquelle)
- Aminosäuregemisch
- Am besten feuchter Untergrund
Durchführung
Zuerst wird das Papier angefeuchtet und am besten auf eine feuchte Oberfläche gelegt. Daraufhin werden einige Tropfen des Aminosäuregemisches auf die Mitte des Papiers getropft. Hiernach wird das Papier an einen Stromkreis angeschlossen und ein Stromfluss durch es erzeugt. Im Folgenden wird ein qualitativer Indikator nach Wahl benutzt, um die Aminosäuren zu erkennen.
Beobachtung
Wir können verschiedene Punkte beobachten an denen sich verschiedene Aminosäuren abgelagert haben. Diese Ablagerungen sind an verschiedenen Orten des Papiers und besitzen eine unterschiedliche Entfernung zu den Polen. Alle jedoch sind auf der gleichen Höhe wie der Ausgangstropfen. Die Tropfen sind bei näherem Hinsehen in verschieden Farben was auf verschiedene Säuren an verschieden Stellen schließen lässt.
Deutung
Aufgrund der Tatsache, dass dies nur bei dem vorhandenen Stromfluss möglich ist, würde ich darauf schließen, dass es etwas mit dem sich bildenden elektrischen Feld zu tun hat. Diese haben die verschieden Aminosäuren angezogen, so wurden diejenigen Säuren welche aufgrund ihres lieblings PH-Wertes gerade negativ geladen sind zum positiven Pol gezogen und andersherum. Doch wie lassen sich nun die verschiedenen Entfernungen erklären oder warum es auch einen Punkt in der Mitte geben kann? Dies liegt bei dem Punkt in der Mitte daran das sich die dortigen Aminosäuren im Zustand eines Zwitterions befinden. Dieser Zustand gibt ihnen eine neutrale Gesamtladung. Somit werden sie von keinem der beiden Pole angezogen. Bei den verschiedenen Positionen was die Nähe zu den jeweiligen Polen angeht, wird dies an der Länge der Aminosäuren liegen, da bei den längeren Säuren natürlich auch mehr Energie aufgewendet werden müsste, um dieselbe Geschwindigkeit und somit die gleiche Entfernung zu erreichen.
Elektrophorese anhand des Beispiels von Lysin, Glycin und Cystein
Um ein Aminosäuregemisch zu trennen, trägt man es auf die Mitte des präparierten Filterpapiers auf und legt eine Gleichspannung an. Da am isoelektrischen Punkt (IEP) die Aminosäuremoleküle als Zwitterionen vorliegen, wählt man den pH-Wert der Pufferlösung möglichst so, dass er dem IEP einer Aminosäure entspricht, die im Gemisch enthalten und uns bekannt ist.
In diesem Fall liegt der pH-Wert der Pufferlösung bei 6 und entspricht damit nahezu dem IEP von Glycin(6,07). Die Glycinmoleküle werden, da sie als Zwitterionen vorliegen und somit neutral geladen sind, weder von der Kathode noch von der Anode angezogen.
Das Lysin liegt in der Pufferlösung mit einem IEP von 9,6 als Kation vor, ist also positiv geladen, und wandert zur Kathode.
Das Cystein liegt mit seinem IEP von 5,05 unter dem pH-Wert der Pufferlösung und liegt in anionischer Form vor. Aufgrund ihrer negativen Ladung wird die Aminosäure von der Anode angezogen und wandert ein Stück aufwärts.
Sie möchten mir einen Kaffee spendieren?
Anmerkungen oder sonstige Ideen und Vorschläge können Sie gern per Mail an info@lernzettel.org bzw. fehler@lernzettel.org senden.