Chemie → Aminosäuren und Proteine →
Proteine
Proteine sind Makromoleküle, welche aus durch Peptidbindungen zusammengeschlossenen Aminosäuren bestehen.
Aufbau
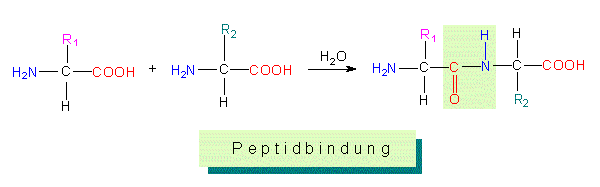
Proteinogene Aminosäuren können durch Kondensationsreaktionen Peptide bilden, wobei sich eine Aminogruppe mit einer Carboxylgruppe verbindet, um eine Peptidbindung einzugehen:
Quelle: http://www1.biologie.uni-hamburg.de/b-online/d17/17d.htm
Die Peptidbindung ist nicht frei drehbar, was für Proteine wichtig ist. Es formt sich eine Peptidgruppe (grün). Das hier entstandene Peptid ist ein Dipeptid, da es aus zwei Aminosäuren besteht. Für die Benennung hier eine Tabelle:
|
Bezeichnung |
Anzahl Aminosäuren |
|
Dipeptid |
2 |
|
Tripeptid |
3 |
|
Tetrapeptid |
4 |
|
Oligopeptid |
<10 |
|
Polypeptid |
>10 |
|
Protein |
>100 |
Struktur
Durch verschiedene Wechselwirkungen kommen vier Strukturen zustande.
Primärstruktur
Die Primärstruktur (Aminosäuresequenz) ist die Reihenfolge der Aminosäuren in dem Protein.
Sekundärstruktur
Durch Wasserstoffbrückenbindungen der Polypeptid-Hauptkette bilden sich charakteristische Strukturen: α-Helix, β-Faltblatt, β-Schleife, β-Helix sowie weitere ungeordnete Strukturen, welche die Sekundärstruktur bilden.
Tertiärstruktur
Die Tertiärstruktur ist die übergeordnete räumliche Struktur, welche durch folgende Wechselwirkungen zwischen den Resten der Aminosäuren entsteht:
- Disulfidbrücken
- Ionenbindungen
- Wasserstoffbrückenbindungen
- hydrophobe Wechselwirkungen
- Van-Der-Waals-Kräfte
Quartärstruktur
Viele Proteine lagern sich zu Proteinkomplexen zusammen, sie formen eine Quartärstruktur. Die Quartärstruktur ist ein Verbund aus mehreren Proteinen oder Polypeptidketten.
Nachweise
Xanthoproteinreaktion
Verdünnte Salpetersäure wird zu einer Proteinlösung gegeben, das Ganze wird erwärmt. Man beobachtet eine gelbliche Verfärbung.
Mit der Xanthoproteinreaktion werden aromatische Aminosäuren in Proteinen nachgewiesen. Durch die Salpetersäure (HNO3) kommt es zur Nitrierung am Benzolring, eine gelbe Nitroverbindung entsteht. Dies geschieht in einer Substitutionsreaktion, ein Wasserstoffatom am Benzolring wird durch die NO2 Gruppe der Salpetersäure vertauscht.
Biuretreaktion
Eine Proteinlösung wird mit verdünnter Natronlauge und Kupfersulfatlösung (Fehling 1 Reagenz) versetzt. Es kommt zur violetten Färbung.
In wässrig-alkalischer Lösung bilden mehrere Peptidbindungen einen farbigen Komplex mit zweiwertigen Kupferionen. Allerdings ist dieser Nachweis unspezifisch und funktioniert auch mit Tyrosinresten.
Denaturierung
Die Sekundär-, Tertiär- und Quartärstruktur können durch physikalische und chemische Prozesse verändert werden, indem es z. B. zur Veränderung von Bindungen / Wechselwirkungen kommt. Der Prozess bei dem diese Strukturen verändert werden, ohne Einfluss auf die Primärstruktur zu nehmen, heißt Denaturierung. Die Denaturierung ist häufig irreversibel, ist sie reversibel (dies tritt auf, wenn der ursprüngliche Zustand energetisch günstiger als der Neue ist), so heißt der Vorgang, welcher zum ursprünglichen Zustand zurückführt, Renaturierung. Die Funktionen eines Proteins gehen mit der Denaturierung verloren.
Hitzedenaturierung
Bei der Hitzedenaturierung werden hauptsächlich Wasserstoffbrücken gebrochen und neu ausgebildet. Hauptsächlich werden Wasserstoffbrücken zwischen Kettenabschnitten verändert, die Tertiärstruktur verändert sich. Die Löslichkeit sinkt, es kommt zum Ausflocken.
Denaturierung durch Druck
Hoher Druck kann Tertiär- und Quartärstrukturen entfalten.
Säure- und Lauge-Denaturierung
In Säuren und Basen kommt es zur Ladungsverschiebung im Protein, unter den jeweiligen Bedingungen fällt das Protein in einen energetisch günstigeren Zustand. Von der Säure abgegebene Protonen verursachen eine Ladungsverschiebung, welche zur Zerstörung von Wasserstoffbrücken führen kann. Einige Aminosäuren besitzen am Rest Carboxylatgruppen (-COO-), mit dem Proton entstehen Carboxylgruppen (-COOH), polare Wechselwirkungen fallen weg. Basen verursachen Deprotonierungen von Carboxyl- zu Carboxylatgruppen, die neuen Ladungen führen zur Veränderung der Struktur.
Säuren und Basen können auch eine Hydrolyse herbeiführen. Es kommt zum Ausflocken.
Denaturierung durch Schwermetallionen
Die Ionen von Schwermetallen (z. B. aus Kupfersulfat) können Komplexstrukturen mit den Aminosäureresten bilden und die Struktur des Proteins verändern. Es kommt zum Ausflocken.
Tyndall-Effekt
Licht wird beim Durchscheinen einer Eiweißlösung gestreut. Dies liegt am Tyndall-Effekt, welcher besagt, dass Teilchen in der Größenordnung der Wellenlänge des Lichts eine Streuung verursachen, falls sie in Flüssigkeiten oder Gas suspendiert sind. Das sichtbare Licht hat eine Wellenlänge von 380-780 nm (1 nm = 10-9 m).
Aussalzen
Zu einer Eiweißlösung wird Kochsalz gegeben. Bei geringer Salzzugabe steigt die Löslichkeit der Proteine, bei höheren Mengen sinkt diese rapide, die Proteine fallen aus. Der Grund ist die Hydratation: das Wasser bildet eine Hydrathülle um die Ionen, es steht nicht mehr für die Wechselwirkung mit den Proteinen zur Verfügung. Es kommt je nach Konzentration des Salzes zum Niederschlag der Proteine.
Sonstiges
- anderer Name für Proteine: Eiweiße
- wichtig den Metabolismus
- Enzyme sind Proteine
- katalysieren Reaktionen
- Abwehrsystem des Menschen (Blutplasma)
- Muskelkontraktion
- je nach Tertiärstruktur in Wasser löslich
- optisch aktiv (alle Aminosäuren bis auf Glycin)
Sie möchten mir einen Kaffee spendieren?
Anmerkungen oder sonstige Ideen und Vorschläge können Sie gern per Mail an info@lernzettel.org bzw. fehler@lernzettel.org senden.